
近日,华南师范大学环境学院应光国教授团队2021级博士生卢志杰、史文俊副研究员等人在《Journal of Hazardous Materials》上发表了题为“An azole fungicide climbazole damages the gut-brain axis in the grass carp”的论文(DOI: 10.1016/j.jhazmat.2024.133463)。该论文通过唑类抗真菌剂氯咪巴唑对草鱼进行42天暴露,发现环境相关浓度下氯咪巴唑会破坏草鱼的肠道四大屏障,从而导致大脑神经毒性。该研究表明水生环境中的唑类抗真菌剂(氯咪巴唑)可通过肠脑轴,介导鱼类的神经毒性,对鱼类健康具有较高生态风险。
图文摘要
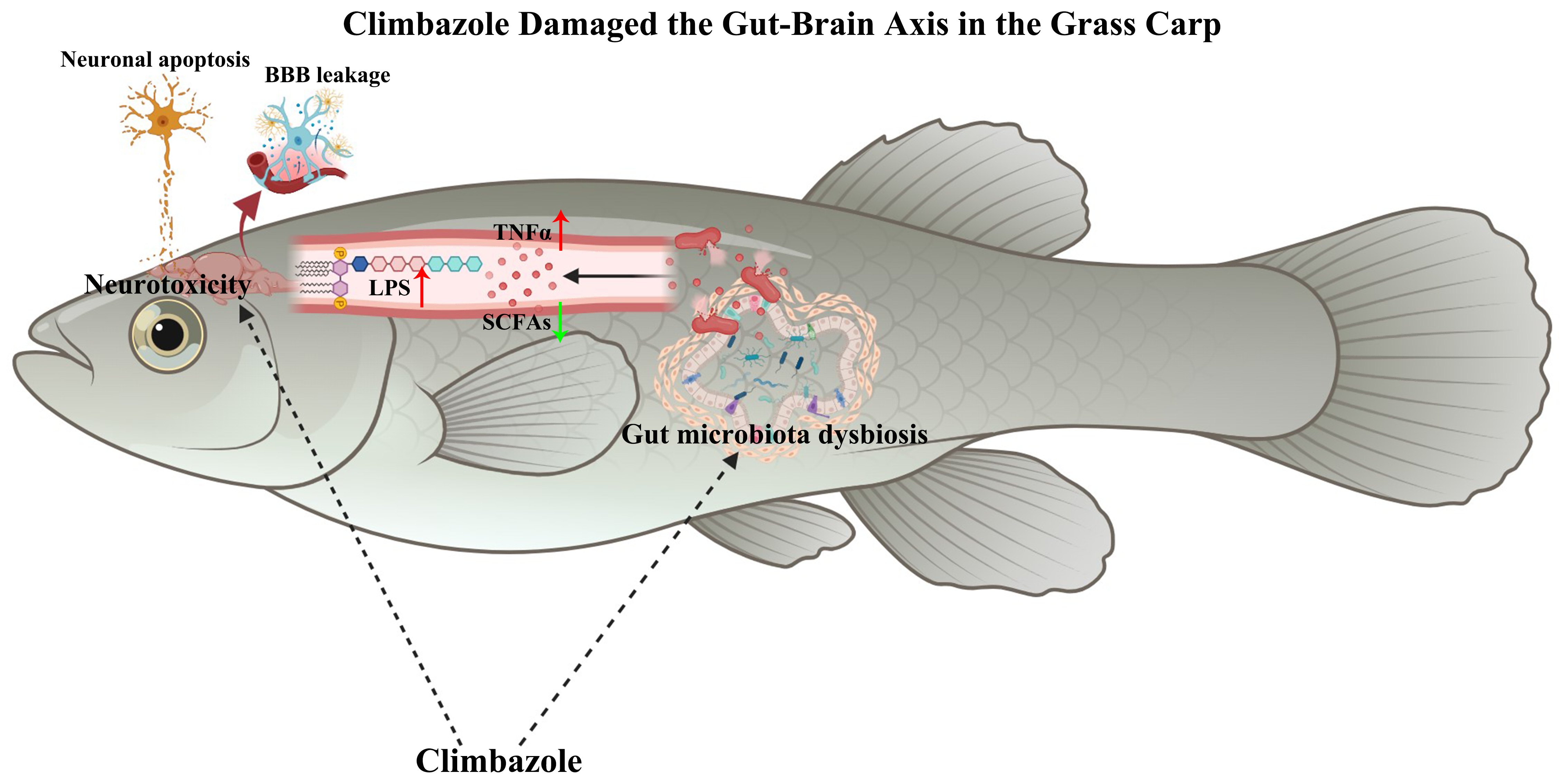
全文速览
唑类抗真菌剂氯咪巴唑在水生环境中被广泛检出,并对鱼类产生发育毒性、内分泌干扰效应和肝脏毒性。然而,氯咪巴唑通过肠—脑轴产生毒性的内在机制尚不清楚。在本研究中,我们通过组织病理学观察、基因转录与表达、生化分析、16S rRNA和ITS的高通量测序,研究了环境浓度下氯咪巴唑对草鱼微生物菌群—肠—脑轴的影响。研究结果表明,连续42天暴露于0.2至20 μg/L的氯咪巴唑扰乱了肠道微生物的丰度,导致肠道、血清和大脑中脂多糖、瘤坏死因子-α和白介素1β的水平升高;继而通过血液循环进入大脑。在大脑中,氯咪巴唑激活NF-κB信号通路增加炎症,并抑制Nrf2信号通路产生氧化损伤,导致细胞凋亡,促进神经性炎症和神经元死亡。以上研究结果表明,草鱼暴露于氯咪巴唑会损害微生物菌群—肠—脑轴,导致大脑神经毒性,对非靶标生物(如鱼类)肠道健康和大脑发育构成生态风险。
引言
唑类化合物具有广谱的抗真菌活性和高稳定性,是植物保护、人类真菌病治疗和兽医领域的首选抗真菌剂。近几十年来,唑类化合物的使用量迅速增加,2015年美国消耗了2940吨唑类化合物,比2000年增加了500%。据估计,到目前为止,全世界每年约使用30万吨唑类杀菌剂。因此,作为一种杀真菌剂,氯咪巴唑也受到了特别关注,因为它被用作化妆品的防腐剂,尤其是用于治疗头皮屑的洗发水和乳液。据预测,欧盟和中国每年的氯咪巴唑消耗量分别为100—1000吨和3800吨。目前,污水处理厂依然无法有效去除氯咪巴唑,其去除率仅为34—76%。因此,在东江流域地表水中检测到的氯咪巴唑最高浓度为264 ng/L。Wick等人还报道,德国溪流(Wicker Bach)中的氯咪巴唑浓度最高,最大值为530 ± 70 ng/L。此外,研究还发现,氯咪巴唑会在鱼类体内富集且持续相当长的时间。研究表明氯咪巴唑还可抑制斑马鱼的视黄酸和性激素分泌,导致色觉缺陷,下调参与类固醇生成的基因,增加谷胱甘肽氧化,并导致细胞凋亡增加。同时,本团队前期研究也发现氯咪巴唑还能导致草鱼肝脏细胞凋亡和脂质代谢紊乱。然而,环境浓度下的氯咪巴唑对鱼类的生态毒性尚未得到全面评估,特别是考虑到其抗菌特性,对肠道微生物菌群的影响。
有趣的是,一些新的研究表明,大脑会影响肠道微生物菌群。同时,肠道微生物菌群也有助于大脑的改变,这被称为微生物菌群—肠—脑轴。然而,微生物菌群—肠—脑轴的机制仍不清楚。胃肠道微生物菌群产生的神经递质、炎症细胞因子、代谢物都有助于建立大脑与肠道微生物群之间的联系。肠道微生物菌群紊乱会引发肠道炎症,如分泌促炎症细胞因子,像肿瘤坏死因子-α(TNFα)和白细胞介素-6(IL-6)。然后,炎症信号(IL-6和TNFα)通过全身循环传递到中枢神经系统,引起大脑神经炎症。此外,短链脂肪酸(SCFAs)是肠道微生物菌群发酵膳食纤维的主要产物。SCFAs在肠道屏障、血脑屏障、小胶质细胞成熟和神经递质合成中发挥着重要作用。此外,脂多糖(LPS)作为革兰氏阴性细菌细胞壁的主要成分,会强烈引起肠道和大脑等组织的炎症。因此,在本研究中,我们通过组织病理学观察、基因转录与表达、生化分析、16S rRNA和ITS的高通量测序,研究了环境浓度下氯咪巴唑对草鱼微生物菌群—肠—脑轴的影响。
图文导读
1. 氯咪巴唑破坏了草鱼肠道四大屏障
(1)机械屏障:使用氯咪巴唑处理的草鱼前肠(FG)、中肠(MG)和后肠(HG)的绒毛长度、宽度和肌肉厚度明显减少(图1A和S3A-B,S6)。同时,氯咪巴唑降低了草鱼肠道紧密连接基因(occludin、zo-1/2、claudin-7a/12/15a)的转录水平(图1D)。此外,FG、MG和HG中的Occludin和ZO-1蛋白表达水平均显著下降(图 1B和D)。
(2)化学和免疫屏障:FG、MG和HG中的杯状细胞(浅蓝色箭头)和柱状上皮细胞(红色箭头)数量明显减少(图S5-6)。氯咪巴唑降低了MG和HG中多个免疫基因的转录,包括igm、leap-2b、mucin-2 和β-defensin(图S7A)。同时,氯咪巴唑还降低了FG、MG和HG中的IgM蛋白水平(图1C和D)。
(3)微生物屏障:细菌和真菌的Shannon(图S8A1和B1)和Chao1(图S8A2和B2)指数在FG和HG有显著差异。在细菌中,L和H组的Shannon和Chao1指数均有所增加。此外,氯咪巴唑暴露都明显破坏了FG、MG和HG中的微生物群落组成(图S8A3和B3),如在FG、MG和HG中观察到较多的细菌(放线菌门和疣微菌门),而拟杆菌门则较少(图1E)。此外,在FG、MG和HG中,真菌群落中担子菌门比例升高,而子囊菌门减少(图 1F)。
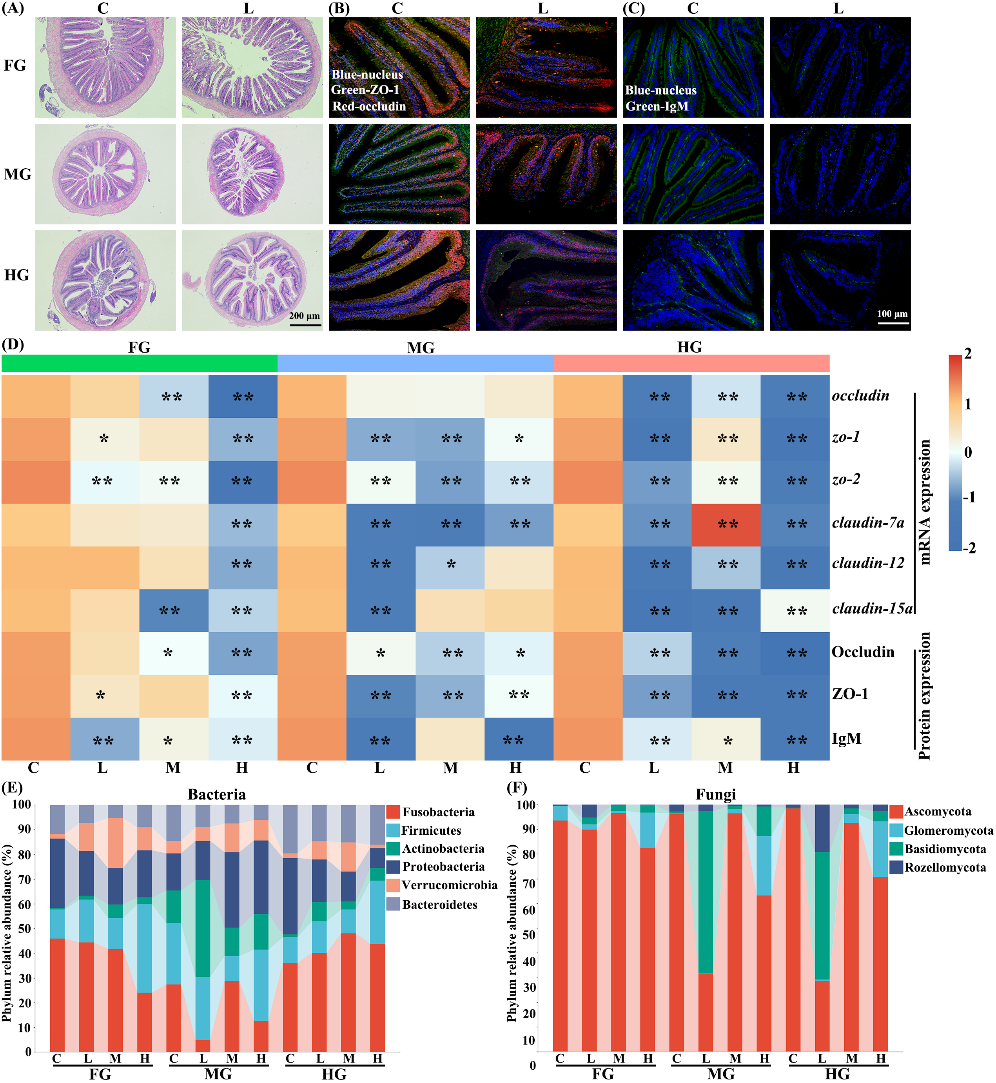
Fig. 1. Intestinal mechanical, immunologic, and microbial barriers of grass carp exposed to climbazole.
图1. 氯咪巴唑损伤了草鱼肠道的机械、免疫和微生物屏障。
2. 氯咪巴唑引起草鱼大脑血脑屏障损伤
(1)组织学变化:图2A和S12A显示,氯咪巴唑暴露组,在颗粒层(GL)和分子层(ML)中,有一些由聚集和溶解的红细胞组成的微血栓(红色箭头);ML和GL出现松散的结构(蓝色箭头),两者之间的间隙增大。此外,在L和H组中,许多GL细胞减少(黑色矩形)。
(2)TEM观察:在氯咪巴唑暴露下,神经元的细胞核(N)染色质减少并边缘化,核膜凹陷并破裂(Ka,蓝色箭头);线粒体(M,红色箭头)和粗面内质网(RER,绿色箭头)大量肿胀、增大和空泡化(图2B和S12B)。图2C和S12C显示,氯咪巴唑导致的大脑组织突触减少,包括树突层受损(D,紫色箭头),突触间隙距离增加(Sc,红色箭头),突触小泡减少(Sv,蓝色圆圈)。
(3)紧密连接相关基因的转录:在氯咪巴唑处理后,occludin、zo-1/2和claudin-7a/7b/12的转录水平明显降低。此外,大脑中Occludin和ZO-1蛋白的表达量也大幅下降(图2D、F和S13A)。
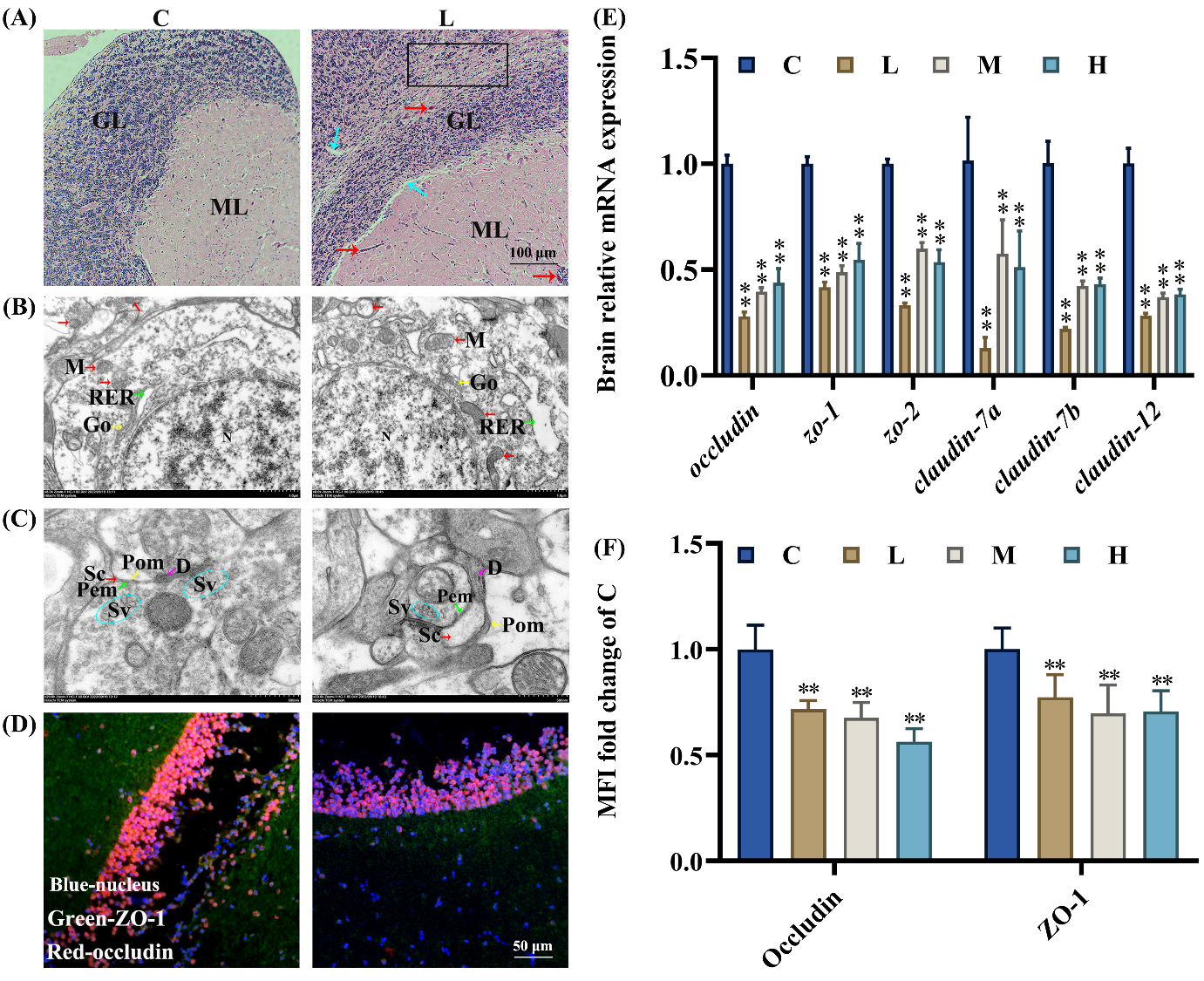
Fig. 2. The exposure of climbazole destroyed the blood-brain barrier.
图2. 氯咪巴唑破坏了血脑屏障
3. 氯咪巴唑诱导大脑神经性炎症和神经元凋亡
(1)神经性炎症:氯咪巴唑暴露后,大脑中的ROS水平显著更高(图3B和S14A)。L和M组NF-κB的mRNA和蛋白水平明显高于C组(图3B-C和S13B)。氯咪巴唑几乎显著增加了下游促炎细胞因子基因(tnfα、il-8、ifnγ、il-1β和il-6)的mRNA表达(图3A)。此外,在L、M和H组中,Nrf2、Keap1和HO-1的mRNA和蛋白表达量也有所下降(图3A-C、S13C和14B)。由于Nrf2水平的降低,sod、cat、gssh、gst和gpx的转录激活随着氯咪巴唑浓度的增加而显著降低(图3A)。在氯咪巴唑产生的氧化应激下,大脑和血清中SOD、GST和GSH的抗氧化能力也降低了(图S14C)。
(2)神经细胞凋亡:氯咪巴唑组显示出更多的TUNEL染色阳性细胞(绿色荧光)(图3B和S15)。L、M和H组抑制了抗细胞凋亡基因(bcl-xl)的转录,同时显著增加了促进细胞凋亡基因的转录水平,特别是tnfr、fasl、fadd、bad1和caspase9(图3A)。此外,L组大脑中的FADD和Bad1蛋白水平明显升高(图S16)。
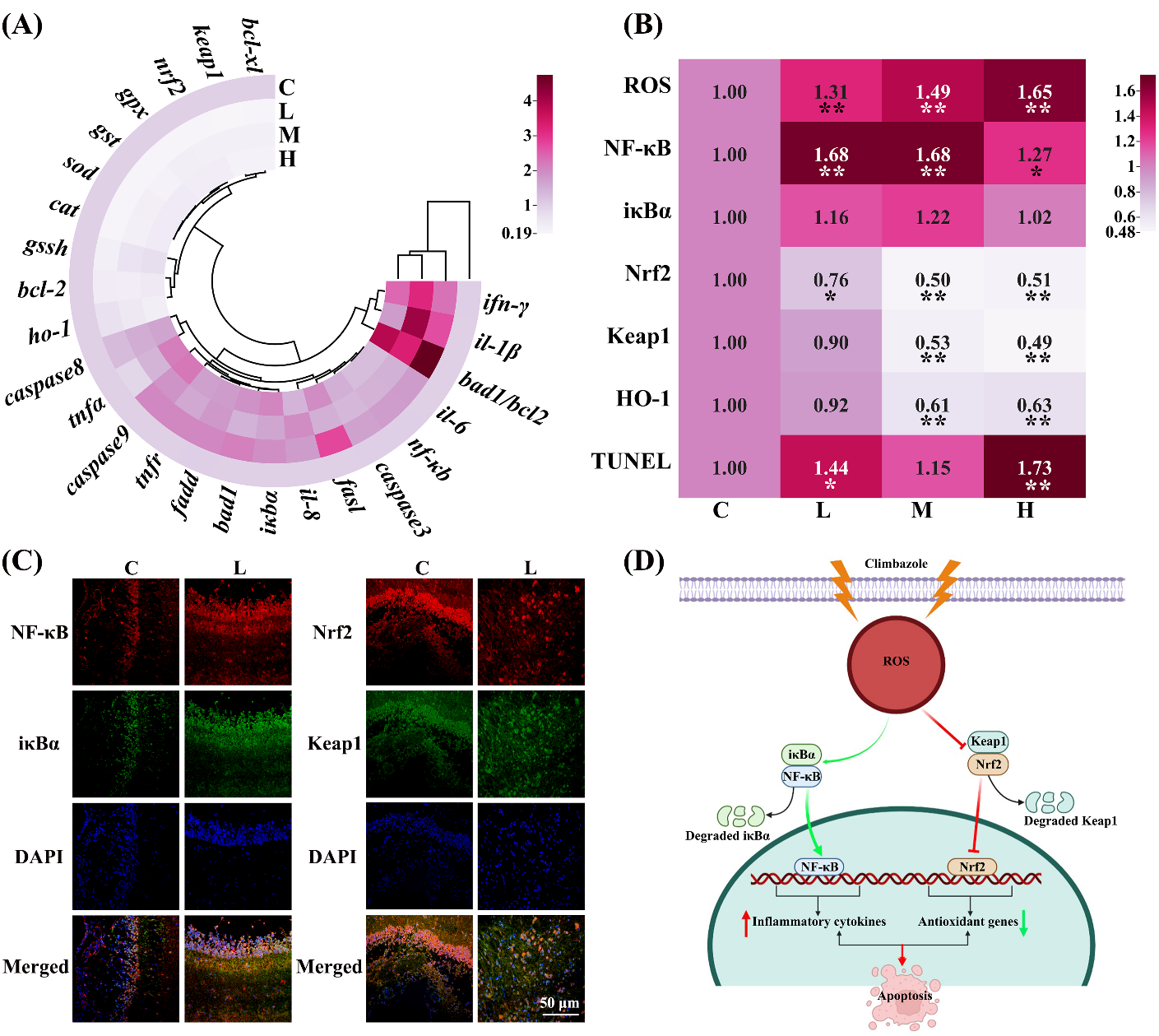
Fig. 3. Climbazole caused apoptosis of brain by inducing inflammation and oxidative toxicity.
图3. 氯咪巴唑通过诱导炎症和氧化毒性导致脑细胞凋亡
4. 氯咪巴唑降低大脑神经递质和神经肽水平
氯咪巴唑抑制了摄食肽相关基因的转录,如nk1ra和sn2;同时显著提高了厌食肽相关基因的mRNA水平,如cart和nmb(图4A)。组织免疫荧光检测发现,暴露于氯咪巴唑后,大脑中酪氨酸羟化酶(TH)蛋白的表达明显减少(图4B和S17)。此外,在M和H组,大脑和肠道组织中的DA和5HT水平显著下降(图 4C)。最后,在L、M和H组中,大脑和肠道中AchE的酶活性显著下降(图4C)。
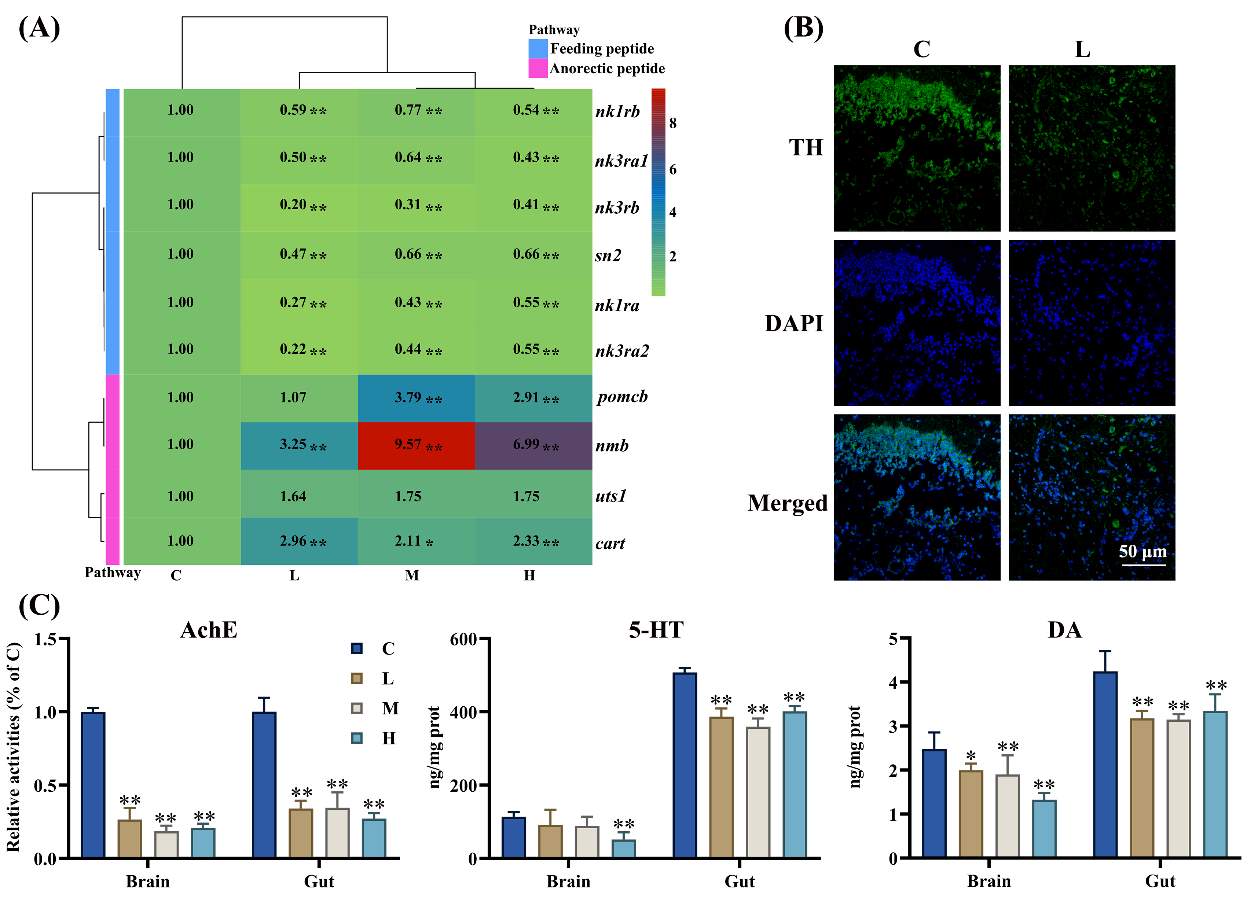
Fig. 4. Climbazole induced neurotoxicity of grass carp.
图4. 氯咪巴唑诱导草鱼神经毒性
5. 肠—脑轴关联性分析
(1)LPS、TNFα和IL-1β浓度:图5A显示,在L、M和H暴露组中,肠道、血清和大脑中的LPS水平显著升高,这也可以通过革兰氏染色进一步证实(图S11)。此外,肠道和大脑中的IL-1β和TNFα浓度在L、M和H暴露后也明显升高。在血清中,IL-1β的含量在M组中上调,TNFα的浓度在L和H组中均升高(图5B-C)。
(2)SCFAs含量:如图5D-E所示,肠道内容物和血清样本中都检测到了八种SCFAs;PCA分析表明,在L、M和H组中,肠道和血清中SCFAs的分布几乎完全一致,这表明氯咪巴唑处理组与对照组之间存在显著差异(图S19)。在L和H组中,己酸、异丁酸和丙酸在肠道中的含量显著下降(图5D)。此外,在H暴露组中,丁酸和乙酸在肠道中的浓度明显下调。此外,在血清中,氯咪巴唑组的八种SCFA含量均显著降低(图5E)。
(3)相关性分析:肠道屏障和神经毒性的生物标志物与肠道微生物群的改变之间存在明显的相关性(图S18);例如,机械屏障和免疫屏障相关基因的转录本和蛋白质分别与FG、MG和HG的绒毛长度、宽度、肌肉厚度以及杯状细胞和柱状上皮细胞的总数呈正相关(图S18A、C、E)。此外,Nrf2通路和神经递质相关基因的转录和表达与血脑屏障(BBB)分析生物标志物呈正相关,而与NF-κB和细胞凋亡通路相关基因的转录和表达呈负相关(图S18G)。此外,我们的研究结果表明,肠道中微生物的丰度与肠道屏障的改变和神经毒性显著相关(r > 0.5,p < 0.05)。例如,在FG、MG和HG中,机械屏障、免疫屏障和化学屏障相关基因的转录本和表达分别与梭杆菌门、厚壁菌门、拟杆菌门和担子菌门呈正相关(图S18B、D、F)。最后,大脑中与 Nrf2、NF-κB和细胞凋亡通路相关的基因转录本和表达量分别与疣微菌门、拟杆菌门和担子菌门呈正相关(图S18H)。
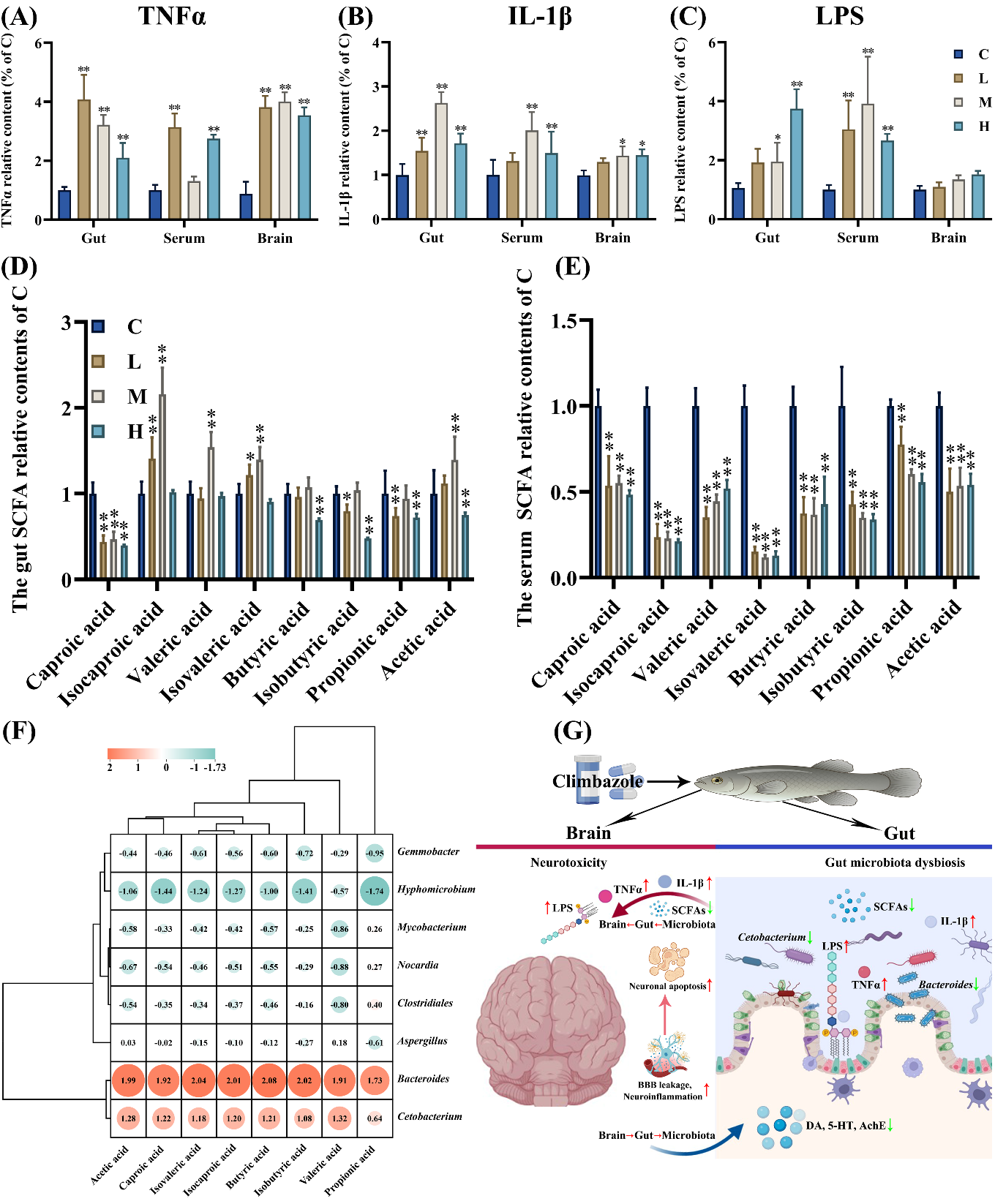
Fig. 5. The gut-brain axis correlations analysis.
图5. 肠道—脑轴之间关联性分析
结论与意义
本研究表明,在环境相关浓度下暴露的氯咪巴唑会导致草鱼脑神经毒性,并破坏肠道屏障。从机理上讲,氯咪巴唑在草鱼大脑中产生过多的ROS,增强了NF-κB通路,导致炎症的产生;同时抑制了Nrf2通路,产生氧化损伤,导致细胞凋亡(图3D),诱发草鱼大脑神经性炎症和神经元死亡。综上,水生环境中的氯咪巴唑等唑类化合物会破坏鱼类微生物菌群—肠—脑轴,从而引起神经毒性,造成生态风险。考虑到淡水生态系统的重要生态功能,草鱼微生物菌群—肠—脑轴的破坏可能会降低其生物量和种群稳定性,从而抑制淡水生态系统的可持续发展。因此,本研究的发现为了解环境污染物如何影响水生生物"微生物菌群—肠—脑轴"通路的调控提供了科学的参考依据。
全文链接
Zhi-Jie Lu, Wen-Jun Shi, Fang-Zhou Gao, Dong-Dong Ma, Jin-Ge Zhang, Si-Ying Li, Xiao-Bing Long, Qian-Qian Zhang, Guang-Guo Ying. An azole fungicide climbazole damages the gut-brain axis in the grass carp. Journal of Hazardous Materials 465, 133463, ISSN 0304-3894. https://doi.org/10.1016/j.jhazmat.2024.133463.
Zhi-Jie Lu, Wen-Jun Shi, Fang-Zhou Gao, Dong-Dong Ma, Jin-Ge Zhang, Si-Ying Li, Xiao-Bing Long, Qian-Qian Zhang, Guang-Guo Ying. Climbazole causes cell apoptosis and lipidosis in the liver of grass carp. Aquat Toxicol. 2023 Oct; 263:106698. https://doi.org/10.1016/j.aquatox.2023.106698.